熱力学を勉強していると「状態量」という言葉が出てきます。例えば圧力と温度は状態量ですが、熱量は状態量ではありません。圧力と体積は状態量ですが仕事は状態量ではありません。エンタルピーやエントロピーは状態量です。
では、状態量とそうではないものの違いは何でしょうか?今回は熱力学の状態量とは何かについて例を交えて解説してみたいと思います。
1. 状態量とそうでないものの違い
そもそも状態量とは何でしょうか?
Wikipediaによると次のようなことが書かれています。
状態量(じょうたいりょう、英語: state quantity)とは、熱力学において、系(巨視的な物質または場)の状態だけで一意的に決まり、過去の履歴や経路には依存しない物理量のことである。元来は熱力学的平衡状態にある系だけで定義されるものだが,非平衡状態にも拡張されて用いられる。
これだけ読んでも良くわからないと思うので、具体的な例をあげていきましょう。
熱力学の状態量として代表的なものに次のものがあります。
- 温度[K]
- 圧力[Pa]
- 体積[m3]
- エンタルピー[J]
- エントロピー[J/K]
一方、状態量ではないものに次のものがあります。
- 仕事率[W=J/s]
- 熱[J]
これらの違いは何でしょうか?
状態量について理解していただくために、人を例に挙げて考えてみましょう。

ここに1人の男性がいます。仮にAさんとしましょう。Aさんの体重、身長、BMIをそれぞれ表してみます。
- 身長:170cm
- 体重:60kg
- BMI:20.8
これらの値はすべて状態量になります。

ここにもう1人の男性がいます、仮にBさんとしましょう。Bさんの体重、身長、BMIをそれぞれ表してみます。
- 身長:170cm
- 体重:60kg
- BMI:20.8
2人とも身長、体重が同一であったとするとBMIは全く同じになります。当然ですね。
さて、ここで仕事や熱に関する情報を付け加えてみたいと思います。
現在の身長と体重が全く同じAさんとBさんですが、実はこれまでの人生が大きく異なります。
- Aさんは昔太っていた時期があり、ダイエットした結果、今の体重や身長になっています。
- Bさんは学生時代からずっと同じ体重をキープしています。
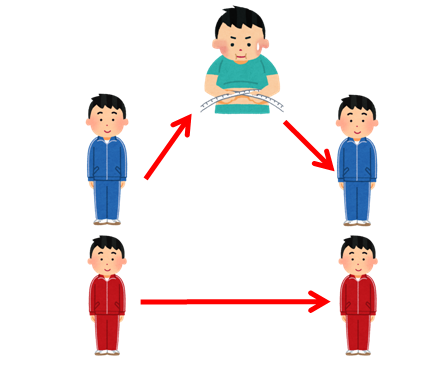
このとき、AさんとBさんではどちらがエネルギーを多く使用したかと聞かれれば、Aさんのほうがエネルギーを多く消費したことになります。このように始まりと終わりの状態が同じであっても、そこに至る経緯によって値が変わってくるものは状態量ではありません。
これを熱力学に置き換えると、温度、圧力、体積、エントロピー、エンタルピーはどのような経緯を辿ったとしてもある一定の数値が得られるので状態量になります。
一方、A地点⇒B地点に至るまでの仕事や熱量というのは始まりと終わりの状態が全く同じであっても経緯によって全く違います。熱力学の場合、等圧変化、等温変化、断熱変化など複数の組み合わせによってその系から取り出せる仕事量や必要な熱量が変わってきます。
こうして考えると、最初に出てきた状態量の定義も何となく理解できたのではないでしょうか?
実際に計算した例もありますのでこちらも参考にしていただければと思います。
2. まとめ
- 状態量は始まりと終わりの状態が同じだと変わらないもの
- 温度[K]、圧力[Pa]、体積[m3]、エンタルピー[J]、エントロピー[J/K]は状態量
- 仕事[W=J/s]、熱[J]は状態量ではない
状態量という言葉は聞きなれないので最初はよくわからないかもしれませんが、概念としてはとても簡単です。